








《化学动力学的应用PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.8 MB,总共有90页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 90页
- 1.8 MB
- VIP模板
- ppt
- 数字产品不支持退货
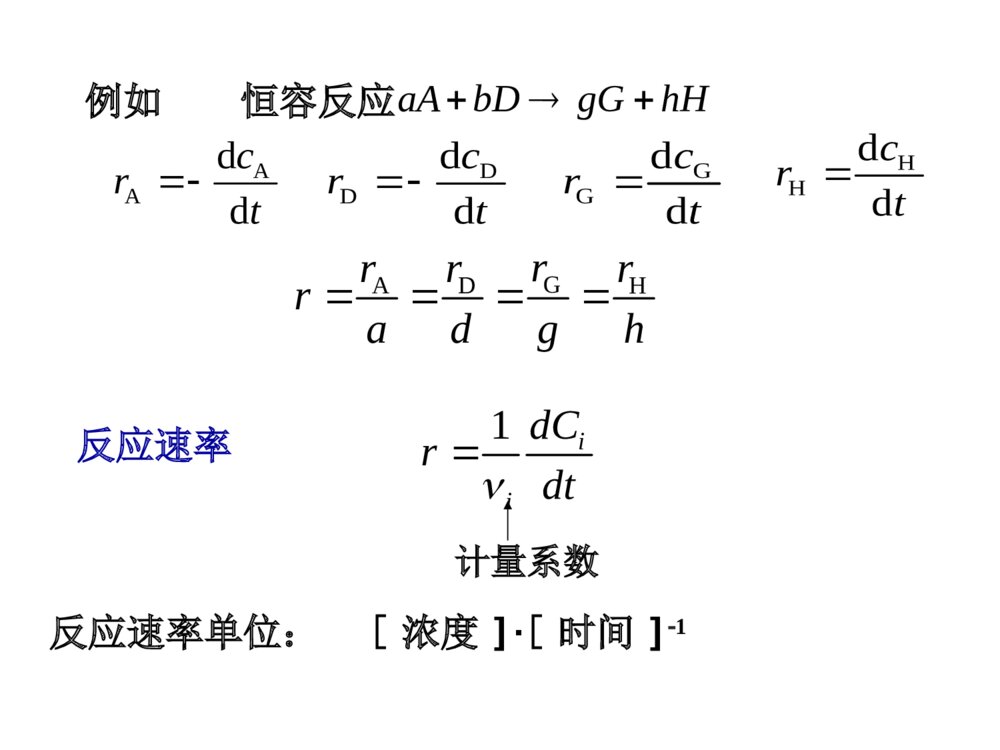
1)研究化学反应的方向和限度2)只考虑从始态到终态化学热力学化学动力学1)化学反应的速率、反应具体过程2)了解和控制化学反应的速率、过程22322213NHNH(g)221HOHO(l)2例如:动力学认为需一定的T、p和催化剂点火,加温或催化剂22322213NHNH(g)221HOHO(l)21rm/kJmolGy-16.63-237.19例热力学只能判断这两个反应都能发生,但如何使它发生,热力学无法回答。化学动力学的应用制药工业根据反应速率计算反应进行到某种程度所需的时间、计算单位时间的产量;通过反应条件对速率的影响选择最优工艺路线。制剂的研制和贮存制剂质量稳定,选择合适条件使药物降解缓慢;了解药物在体内的吸收、分布、代谢、排泄速率等。化学动力学的研究内容1)化学反应的速率2)反应条件对反应速率的影响3)反应具体过程,即反应机理4)药物有效期的预测第一节基本概念在均相(或单相)反应中,单位时间、单位体积内,反应系统中各组分的物质的量的改变量。()iiinddCVrdtdt在恒容条件下,体积V为常数,则一、化学反应速率瞬时反应速率r1iidnrVdt反应速率单位:[浓度]·[时间]1例如恒容反应aAbDgGhHAAddcrtDDddcrtGGddcrtHHddcrtGADHrrrrradgh1iidCrdt反应速率计量系数例N2+3H22NH3tcrdd2Ntcdd312Htcdd213NH对于气相反应,可用压力随时间变化率表示322NHNHddd11d3d2dppprttt此时,速率r的单位为[压力][时间]12BrHHBrH二、基元反应由反应物微粒(分子、原子、离子或自由基等)一步直接生成产物的反应。例22BrBr复杂反应:由几个基元反应组成的反应。三、反应分子数22BrBr指参加基元反应的反应物的微粒数。反应分子数只能是正整数。单分子反应双分子反应三分子反应2BrHHBrH基元反应{尚未发现大于三分子的反应2A+B→C四、反应速率方程与反应级数及速率常数微分速率方程(或速率方程)以微分形式表示的反应速率与各反应组分浓度之间的函数关系式。积分速率方程(或动力学方程)用积分形式表示的反应组分浓度与时间的函数关系式。r=f(c)c=f(t)速率方程必须由实验确定AD()rfckccAD()rfckcc反应对反应物A是级,对D是级,反应总级数n=+2O2NOckcr该反应对NO是二级,对O2是一级,反应的总级数为三级;例反应aAbDgGhH例由实验确定速率方程反应级数整数分数零负数反应级数简单反应的反应级数一般为正整数H2+Br22HBr222121HBr2HBrBr1kccrkcc复杂反应的级数比较复杂例速率常数ADrkcc物理意义k与温度、反应介质、催化剂等因素有关。对于不同级数的反应,速率常数k的量纲不同。速率方程式中k称为速率常数各反应物均为单位浓度时的反应速率,其大小与反应物的浓度无关。影响因素量纲五、质量作用定律对于基元反应aA+dDPdackcrDA基元反应的反应速率与反应物浓度幂的乘积成正比,这个关系就是质量作用定律。反应物浓度的指数是计量方程式中各反应物的计量系数适用范围:只适用于基元反应练习请根据质量作用定律写出下列基元反应的速率方程式(1)A+B→2Pr=kcAcB(2)2A+B→2P(3)A+2B→P+2S(4)2Cl+M→Cl2+Mr=kcA2cBr=kcAcB2r=kcCl2cM六、计量方程与机理方程计量方程例如2O33O2机理方程表示实际反应过程的方程32OOO(1)(2)322OOO只表示始、终态反应物与产物的数量关系每一个机理方程都是基元反应,都能运用质量作用定律第二节简单级数反应概要一、一级反应反应速率与反应物浓度的一次方成正比的反应是一级反应。APAAddAckct积分A,0AlnAcktc反应速率对于反应,001()AACtAACAdCkdtC得AA,0Aktcce指数形式反应物浓度随时间呈指数减小,只有t=∞,才有cA=0.从理论上说,一级反应需要无限长时间才能反应完全。(许多生理反应、药物在体内吸收、分布、代谢和排泄等过程都可视为一级反应。)一级反应的特点1.速率常数k的量纲:[时间]-1单位s1(或min1,h1,d1等)tlnC2.AA,0lnlnccktlncA~t为直线,斜率为–k,截距为lncA,0A,0Alncktc由式3.半衰期:反应物浓度降低至初始浓度一半所需要的时间12ln20.693tkk0.91ln0.10590%tkk一级反应的半衰期与初始浓度无关!十分之一衰期(有效期):药物分解,浓度降至初始浓度的90%所需要的时间,记为t0.9)(1073.82.40.5ln20113monthk)(413.00.50.50.5ln1073.813montht例1:某药物分解30%即失效,含此药物的样品初浓度为5.0mg·mL-1。室温下放置20个月后浓度降为4.2mg·mL-1,设此药物分解为一级反应。问标签上注明使用的有效期是多久?再求有效期:解:先求反应速率常数。将数据代入例2某药物注射剂注入机体后,于不同时间测得血液中的药物浓度为t(h)481216C(mg/100mL)0.480.310.240.15试问:(1)该药物在体内的变化是几级反应?(2)该药物在体内的半衰期为多少?(3)若要保持药物在血液中的浓度不低于0.37mg/100mL,第一次注射后需多长时间进行第二次注射?t(h)481216lnC-0.73-1.17-1.43-1.90解:(1)由题给数据得如下数据:(2)从lnC-t的直线关系求斜率,或用线性回归法求斜率,其数值为-9.36×10-2h-1,所以k=-斜率=9.36×10-2h-1t1/2=0693069393610742....()kh210.69ln6.7()9.36100.37th(3)由作图法或线性回归法所得截矩求得第一次注射后血液中该药物的初浓度C0=0.69mg/100mL,降至0.37mg/100mL所需时间所以必需在第一次注射约6小时后进行第二次注射。以lnC对t作图,得一直线。可见该药物在体内的变化为一级反应。二、二级反应简单的二级反应2AP微分速率方程2AAAddckct积分式AAA,011ktccA+BPAABddckcct若二级反应为反应速率与一种反应物浓度的二次方成正比;或反应速率与两种反应物浓度的一次方的乘积成正比。反应速率方程为,0,0,0,01lnBAAABABCCktCCCC二级反应的特点1.速率常数k的量纲为[浓度]1[时间]1,单位为mol1·L·s1或mol1·m3·s1等;2.~t为直线,其斜率为kA,截距为;A1cA,01c3.半衰期为12AA,01tkct1/cAAAA,011ktcc例3乙酸乙酯的皂化反应为CH3COOC2H5+NaOHCH3COONa+C2H5OH已知该反应对CH3COOC2H5和NaOH均为一级,NaOH和CH3COOC2H5的初始浓度都为2.04×102mol·L1。在25C将NaOH和CH3COOC2H5的溶液等体积混合进行反应,测得反应的速率常数为4.91mol1Lmin1,求(1)反应的半衰期;(2)反应完成95%所需要的时间。解:(1)0A,c=2.041020.5=1.02102mol·L197.191002.191.41120,A21kctmin2AA,0111111379195%1.021014.91kcct(2)min已知某滴眼液的眼部药物动力学可按一级反应处理。实验时于不同时间测房水中的药物浓度,经计算得药物在眼部的吸收速率常数为0.372h1。试问:(1)该药物在眼部的半衰期为多少?(2)已知第一次滴眼后房水中药物的初始浓度为3.32g·mL1,若要保持药物在房水中的浓度不低于1.50g·mL1,第一次滴眼后需多长时间再进行第二次?解:(1)12ln2ln21.86h0.372tkA,0A1lnckc13.32ln2.14h0.3721.50t=(2)课堂练习作业P922、3、4、5三、零级反应反应速率与反应物浓度无关的反应称为零级反应微分速率方程0AAddAAckcktcA,0cA=kAt积分速率方程tcA零级反应的特点1.速率常数k的量纲为[浓度][时间]1,单位mol·L1·s1mol·m3·s1等。cA~t为直线,其斜率为–k,截距为cA,03.半衰期kct2A,021零级反应的cA~t曲线常见零级反应:光化学反应、表面催化反应、电解反应;混悬液中药物的降解。cA,0cA=kt2.5%11100002.例4某药物溶液配制5天后分解1%,问需多少天分解10%?设该药物分解为零级反应。=0.002(mol·L-1·d-1)=50(d)解:反应的速率常数k=则t0.9=反应级数动力学方程k的量纲线性关系半衰期零级反应cA,0cA=kt[浓度][时间]1cA~t一级反应[时间]1lncA~t二级反应[浓度]1[时间]1ktccAA,0lnAA,011ktccA1~tckct2A,02/1kt2ln21A,02/11kct简单级数反应的动力学方程及特点已知浓度小于0.33g/100ml的阿司匹林水溶液的降解为一级反应,其一级降解反应速率常数k1=5×10-7s-1.阿司匹林悬浮液的浓度13g/100ml,其饱和溶解度为0.33g/100ml。求阿司匹林悬浮液降解的零级速率常数k0及t0.9。课堂练习解:临界浓度时r1=r07711015100.331.6510(100)kkCsgmls,060.9700.10.1137.8810911.6510ACtsdayk四、反应级数的确定方法积分法半衰期法微分法孤立法1、积分法(1)尝试法将多组(c,t)数据,代入各简单级数反应的积分式中,计算速率常数k,确定反应级数。2、半衰期法(2)作图法一级反应lnCA—t直线二级反应1/CA---t直线零级反应CA---t直线实验浓度范围应足够大,才可确定反应级数。dCdtA=kCAnt1/2=KCA,01-n3、微分法nAAkCdtdCrlnr=lnk+nlnCAlnr—lnCA直线,斜率=nCAtdtdCA1,dtdCA2,4、孤立法先变化一种反应物浓度,测另一种反应物浓度与反应速率r的关系;各自孤立,一种大量测定另外一种。第三节典型的复杂反应概要由两个或两个以上的基元反应以某种方式联系起来的反应称为复杂反应。复杂反应最简单的复杂反应有对峙反应平行反应连续反应链反应一、对峙反应正逆两个方向都能进行的反应称为对峙反应.最简单的1-1级对峙反应ABk1k2r=dCdtA=k1CA-k2CB=k1CA-k2(CA,0-CA)=(k1+k2)CA-k2CA,0当反应达到平衡时,r正=r逆,r=0,CA=CA,e,CB=CB,e=CA,0-CA,e∴(k1+k2)CA,e=k2CA,0=(k1+k2)CA-k2CA,0=(k1+k2)(CA-CA,e)ln(),,,CCCCkktAAeAAe012或ln(CACA,e)=-(k1+k2)t+ln(CA,0CA,e),可联合求解得到k1、k2。定积分得dCdtAln(CACA,e)~t直线,斜率为(k1+k2)kk12若测得平衡常数Kc=二、平行反应反应物同时进行两个或两个以上不同的且相互独立的反应称为平行反应。一般将速率较大的或生成目的产物的反应称为主反应,将其它反应称为副反应。一级平行反应ABCk1k2dCdtkCkCkkCAAAA1212()ln(),CCkktAA012CCeAAkkt,()012定积分或lnCA~t直线,斜率为-(k1+k2)ABCkdtdC1dCdtkCCA2CCkkBC12三、连续反应一个化学反应要经过连续的几步才能得到产物,并且前一步的生成物为后一步的反应物,则该反应称为连续反应。dCdtkCAA1dCdtkCkCBAB12dCdtkCcB2,,ABCk1k2第四节温度对反应速率的影响范特荷夫(Van’tHoff)规则温度每升高10K,反应速率大约增加24倍可粗略估计出温度对反应速率常数的影响24kIVTkTIkTIIITkVkTII速率常数k与温度T的关系阿仑尼乌斯型酶催化反应烃类转化反应一、阿仑尼乌斯经验公式(Arrhenius)a2dlndEkTRT=Ea阿氏活化能或实验活化能(J·mol1或kJ·mol1)k反应速率常数T温度aeERTkAalnlnEkART=-+指数形式不定积分式A指前因子,又称为频率因子,量纲与k相同a212111lnEkkRTT定积分式微分形式意义:描述了反应温度对反应速率的影响Arrhenius公式适用范围:基元反应、复杂反应对于基元反应Ea有明确的物理意义在复杂反应中Ea又称为表观活化能二、活化能基元反应中,活化分子的平均能量与反应物分子的平均能量之差即为活化能。活化能的微观解释E3反应坐标正逆向反应的活化能之差为反应热Q。恒容反应,QV=U△;恒压反应,Qp=H△Ea1能量E1E2Ea2Q活化能Ea的测定方法:作图法alnlnEkART=-+REa以lnk对1/T作图可得一条直线,直线的斜率为计算法12a1211lnTTREkk例CO(CH2COOH)2在水溶液中发生分解反应,已知283K时k=1.080×104s1,303K时的速率常数为1.670×103s1,试求算反应的活化能。解:由公式12a1211lnTTREkk代入数据得34E1.6701011ln1.080108.314303283a解得:Ea=97.61kJ.mol-1作业P92-931、6、8第五节光化学反应光化学与热化学反应的区别光化学反应:由光照射而引起的化学反应。热化学反应光化学反应活化能来自吸收的热量来自吸收的光量子反应方向等T等PW’=0G<0△△G<0或△G>0均有可能反应速率随温度升高而增大受温度影响较小入射光的波长与强度一般不影响热反应的平衡对光化学反应有很大影响一、光化学反应的基本定律1、光化学反应第一定律只有被体系吸收的光才能有效地引起光化学反应。初级过程:必须在光的照射下才进行,反应物分子或原子吸收光量子后成为激发态的分子或原子。次级过程:初级过程经极短的瞬间,在不需要光的情况下发生一系列的热反应,也称退激过程。例:HI的光化分解反应初级过程HI+h→I·+H·次级过程H·+HI→H2+I·I·+I·→I22、光化学反应第二定律/光化当量定律一个分子或原子吸收一个光量子而被活化。2334816.022106.626102.998100.1196()AANhcuNhJmol活化1mol分子或原子需要吸收1mol的光量子,它所具有的能量称为一个爱因斯坦。二、量子效率发生反应的分子数被吸收的光量子数1.5710744.210358.41196.01196.0molJu6510515.410744.2%1.8011050014.06.1610515.4105.765例肉桂酸在光照下溴化生成二溴肉桂酸。在温度为303.6K,用波长为435.8nm,强度为0.0014J.s-1的光照射1105s后,有7.5×10-5mol的溴发生了反应。已知溶液吸收了入射光的80.1%,求量子效率。量子效率为解:入射光的Einstein值为吸收的光量子的摩尔数为第六节反应机理的确定一、确定反应机理的步骤(1)由实验数据确定反应的速率方程和活化能大小;(2)据化学、结构知识拟定反应机理,导出速率方程并与经验速率方程比较;(3)从理论或实验方面,尽可能多方面的对所拟机理进行验证。二、稳态近似即近似认为:中间产物的生成速率=反应速率,浓度不随时间改变。连续反应:021GAGCkCkdtdC常用于研究连续反应、链反应中生成活泼自由基或自由原子的反应。如果k2»k1,例如在中间产物G为活泼的自由原子或自由基等的反应,可认为G一旦生成,立刻进行下一步反应生成产物H。HGAkk21例H2与Br2的反应计量方程式为HBrBrH222初步拟定其反应机理为:试证明其反应速率为:rkCCkCCHBrHBrBr222121\'(1)Br22Br.(2)Br.+H2k1k2HBr+H.(3)H+Br2.HBr+Br.k3(4)H.+HBrk4H2+Br.(5)2Br.Br2k5HBrHBrHHBrHBrCCkCCkCCkdtdC43222由稳态近似法dCdtkCkCCkCCkCCkCBrBrBrHHBrHHBrBr1234522220043222HBrHBrHHBrHCCkCCkCCkdtdC①②①②式相加得:CkCkBrBr()15122CkCkCkCkCkHHBrHBrBr2341512222()2223421215121)(2BrHBrBrHHBrCCkkCCkkkdtdC代入速率方程得:222211BrHBrBrHCCkCkC三、平衡近似某连续反应ABCk1k-1k2若k1>>k2,k-1>>k2,则可近似认为A、B处于平衡状态。CCCCKkkBABeAe,,11CkkCBA11产物的生成速率dCdtkCkkkCcBA2121例NO的氧化反应的计量方程式为2NO+O2→2NO2经实验确定此反应为三级反应,其速率方程为dCdtkCCNONOO222试证明其反应机理为:k2k12NON2O2222223NOOONk(快)(慢)根据上述机理可写出速率方程:222232OONNOCCkdtdC根据平衡近似法KkkCCNONO1222222122NOONCkkC2222312ONONOCCkkkdtdC2312kkkk令:222ONONOCkCdtdC则:式中k称为表观速率常数2312kkkkRTEaeAkRTEEERTERTERTERTEeAAAeAeAeAAe23123123123122表观活化能E=E1+E3-E2表观指前因子2312AAAA四、速控步(决速步)反应机理中最慢的一步反应称为速控步。k3¿ìËÙ·´Ó¦-+BrH2O++C6H5N2C6H5NH2+ONBr×îÂýk2+H2OONBr-Br++H2NO2k-1k1¿ìËÙƽºâ+H2NO2HNO2++H例如反应总反应速率等于最慢步的反应速率。rkCCHNOBr222第八节催化作用一、催化作用简介催化剂:一种或多种少量的物质加到化学反应系统中,可以改变反应的速率而其本身的数量和化学性质在反应前后都不改变,这种物质称为~正催化剂:加快反应速率负催化剂:减慢反应速率催化反应均相复相酶催化反应二、催化作用的基本特征:1、催化剂参与反应,并改变反应的历程,显著地降低反应的活化能.催化机理2、催化剂能显著地改变化学反应的速率,但它不影响化学平衡,不改变化学反应的可能性。3、催化剂具有选择性。4、催化剂对某些杂质很敏感。5、反应过程中催化剂的变化。k3AB+KAK+BAKA+Kk1k2催化机理BAKABCCkdtdC3反应速率用平衡近似法处理KkkCCCKAAK21BABAKABCCkCCCkkkdtdC\'231])(exp[)(\'231231231RTEaEaEaCAAACkkkkKKKaaaaCAAAAEEEE231\'231\'问:某反应在一定条件下的平衡转化率为22%,当加入催化剂时反应速率增加了20倍,若保持其它条件不变,其转化率为多少?答:不变。因为催化剂只影响反应速率,不改变化学平衡状态第九节酸碱催化广义酸HA催化机理广义碱B催化机理S+HASH++A-(慢)SH++A-P+HA(快)HS+BS-+HB+(慢)S-+HB+P+B(快)酸碱催化反应均以质子转移来完成反应若反应可被、碱、溶剂催化,则总的反应速率为rkCkCCkCCsHHnsOHOHms0kHK0溶剂参与下反应自身的速率常数Cs反应物的浓度kH+kOH-酸碱催化系数,代表催化剂的催化能力CH+COH-H+与OH-离子的浓度n、m反应对H+OH-的级数,通常为1在pH值较低时,主要为酸催化反应:HHCkkk0通过一系列k0和CH+可计算k0kH+kkkCkCHHnOHOHm0上式表明溶液的pH值对反应速率的影响由于skCr作业P93-9413、14、15、16、17、21练习:已知H2和I2反应生成HI的反应机理为:k1k2I2(g)2I(¿ì)H2+2Ik32HI(慢)试证明此反应的速率公式为:dCdtkCCHIHI22第十一节药物稳定性的预测药物制剂质量的标志稳定性生物利用度药物制剂的稳定性分为:化学稳定性物理稳定性生物稳定性一、影响药物化学稳定性的因素温度、pH值、湿度、光照、药物相互作用等。例:青霉素具有酰胺结构,易水解,其稳定性受水气影响很大;肾上腺素具有酚类结构,Vc具有烯醇结构,易氧化,其稳定性受空气影响很大。二、药物贮存期的预测1、留样观察法考察药物在室温情况下实际放置至质量指标不合格所经历的时间,是为留样观察法测得的药物贮存期。优点:准确适用于老产品的质量考察,考验加速试验结果的最可靠标准;缺点:费时不适用新处方、新制剂的考察。2、加速试验法(1)恒温法①在不同的加速温度下,测定各温度下药物浓度随时间的变化;②求得药物降解反应级数及在各试验温度下的反应速率常数k;③然后依据Arrhenius公式,以lnk对1/T作图,外推求得药物在室温下的速率常数k25℃;④计算室温下药物含量降至合格限所需的时间,即贮存期。例:抗坏血酸(Vc)在水溶液中的氧化分解是假一级反应。配制10%Vc水溶液,封于2ml安瓿,分放在5个恒温水浴中加速分解。加速温度为60,℃5,70,75℃℃C,80C,分别按一定时间间隔取样,用碘量法分析含量。T(C)t(h)I2消耗量(ml)lgI2T(C)t(h)I2消耗量(ml)lgI2023.141.3644023.161.36471222.731.35666.222.471.3516602422.381.34997512.221.801.33853621.841.339318.221.071.32374821.631.335124.220.301.3075023.171.3649023.091.363410.322.691.3558422.471.35166520.322.171.345880821.901.340430.321.561.33361221.161.325540.321.151.32531620.571.3132023.171.36497.122.611.35437014.122.021.342821.121.221.326728.120.691.3158t(C)1/T(103K-1)斜率(103)k(103h-1)lgk603.0010.6251.451-2.8383652.9571.002.298-2.6387702.9141.704.126-2.3844752.8722.375.432-2.2651802.8313.217.272-2.1384将15.29811T代入回归方程得:k298.15=5.38310-5h-1daykt8210383.5105.0105.05259.0(2)变温法变温法则是在一定温度范围内,连续改变温度,通过一次试验即可获得所需的动力学参数(活化能、速率常数及贮存期等)的方法。与经典恒温法相比,变温法可节省时间和样品,减少试验工作量。变温法又分为程序升温法和自由升温法两大类:fCkEaRTatdtfCt()exp[(.)]()2980001298151第七节反应速率理论一、碰撞理论1、基本假定:①分子看作刚球,除碰撞时以外,分子间不存在相互作用;②分子必须经历碰撞才能发生反应;③只有相互碰撞的一对分子所具有的平动能超过某一临界值,才能发生反应。这样的分子称为活化分子,活化分子的碰撞称为有效碰撞。④单位时间单位体积内发生的有效碰撞次数就是化学反应的速率。碰撞频率:单位时间单位体积内分子A、B的碰撞总次数。ZABA+B→P有效碰撞分数:有效碰撞次数的比例,即活化分子数Ni占总分子数N的比例。Ni/N2、NNZdtdNriABA单位时间单位体积A分子与B分子的碰撞频率ZAB=(rA+rB)2uNANB(1)气相分子中的碰撞频率ZAB单位时间里一个A分子与B分子的碰撞数ZAB\'=(rA+rB)2uNB(2)有效碰撞分数NNi根据Boltzmann能量分布定律,气体中平动能超过某一临界值Ec的分子在总分子中所占的比例为:RTEcieNNEc称为临界能,或碰撞活化能根据Maxwell速率平衡分布定律RTu8BAABBABAABNNRTDNNRTrrZ88)(22DAB=rA+rB3、碰撞理论的不足(1)必须知道临界能EC,失去了从理论上预言k的意义;(2)假设反应物是刚性球体,这个假设过于粗糙.(3)反应速率BARTEcABACCeRTDNdtdCr/208RTEcABABeRTDNk/208Ea=Ec+1/2RT∵Ec》1/2RT,Ea≈Ec二、过渡态理论CAC]B[ABBCA慢快快KCCCABCABCCKCCABCABCrdCdtCKCCABCABCABCh=kBTKhTkkB理论上,只要知道活化络合物的结构,就可用热力学、量子力学和物质结构的数据求出K。作业P93-9512、23



















